

江苏国控电力设备有限公司
Jiangsu guo kong power equipment Co., Ltd.

1971 年,Folkman 教授提出“肿瘤要靠新生血管才能长大”,科学家发现:若能阻止肿瘤新生血管的生成,就等于切断了癌细胞的“粮草供应线”,肿瘤将无法继续生长甚至转移。这一战略思想催生了一类革命性药物——抗血管生成药物。半个多世纪后,抗血管生成药已成为肿瘤治疗的“第四大手段”(继手术、放化疗、免疫治疗之后)。
1
肿瘤的生存之道:血管生成之谜
当肿瘤组织在体内悄然生长时,它会产生巨大的机械应力,导致周围血管壁厚度不均、结构变形。这些血管以不规则的螺旋状密集出芽,阻碍血液正常流动,减少氧气和营养供应。 面对缺氧缺营养的危机,肿瘤细胞展现出惊人的求生本能:分泌多种促血管生成因子,刺激内皮细胞增殖与迁移,推动新血管的形成。新生的血管不仅为肿瘤输送氧气和养分,更为癌细胞扩散至其他器官开辟了路径。 在众多调控因子中,VEGF/VEGFR信号通路占据主导地位。VEGF(血管内皮生长因子)控制着内皮细胞的增殖与存活,而其受体VEGFR则位于内皮细胞表面8。 其中VEGF-A是血管生成最重要的调节因子,在肿瘤生长、增殖、侵袭、转移和耐药性方面起着关键作用。VEGF-A/VEGFR-2通路成为生理和病理血管生成的核心信号通道,能刺激内皮细胞的有丝分裂、趋化和形态发生,直接促进实体瘤的增殖和转移 2 药物分类:三大策略阻断肿瘤生命线 根据作用机制的不同,抗血管生成药物主要分为三类: 1. 大分子单靶点血管生成抑制剂 贝伐珠单抗:全球首个获批的抗肿瘤血管生成靶向药物,可特异性结合VEGF-A 雷莫芦单抗:选择性靶向VEGFR-2的胞外区域 阿柏西普:融合蛋白类药物,用于治疗多种视网膜疾病和转移性结直肠癌 2. 小分子多靶点血管生成抑制剂 仑伐替尼:抑制VEGFR1-3、FGFR1-4等多个激酶 安罗替尼:中国自主研发,有效抑制VEGFR、FGFR、PDGFR等多个靶点 阿帕替尼:中国首个口服小分子TKI,特异性抑制VEGFR-2 3. 内源性泛靶点血管生成抑制剂
这类药物以单克隆抗体和融合蛋白为代表,具有高纯度、高特异性的特点。它们像精准制导导弹,锁定特定靶点实施打击:
这类药物可同时抑制多个激酶靶点:
如重组人血管内皮抑制素(恩度),通过多途径抑制血管内皮细胞迁移和肿瘤新生血管形成。
3 3 常见不良反应及应对策略 抗血管生成药物的不良反应主要源于其对正常组织微血管环境的影响。当抑制VEGF-VEGFR通路时,身体正常部位的血管生长及功能也会受到波及。 1. 高血压 阿帕替尼治疗晚期胃肠道肿瘤患者的高血压发生率35.2% 乐伐替尼在肝细胞癌试验中高达44.5% 的患者出现高血压 应对:治疗第一个周期每周测血压,后续每2-3周一次。出现头痛、头晕等症状要警惕。轻度升高可用常规降压药控制;收缩压≥160mmHg或舒张压>100mmHg时需暂停用药并就医。 2. 出血风险 乐伐替尼研究中24.6% 的患者存在出血,其中5.0%为严重出血 安罗替尼3级及以上咯血比例为3.06% 贝伐珠单抗出血发生率高达20%-60%,且有因出血死亡的病例 应对:密切监测凝血功能。出现2级出血(需治疗)暂停用药;3级(需输血)或以上出血永久停药。 3. 蛋白尿 贝伐珠单抗可导致18% 的患者出现尿蛋白,其中2.4% 为严重蛋白尿。 应对:定期尿检。24h尿蛋白>2g暂停治疗;出现肾病综合征(24h尿蛋白>3.5g)永久停药。ACEI/ARB类降压药可辅助降低蛋白尿36。 4. 手足综合征 应对:预防性使用维生素B6,减少手足摩擦。出现2级以上症状持续7-10天未缓解,需中断治疗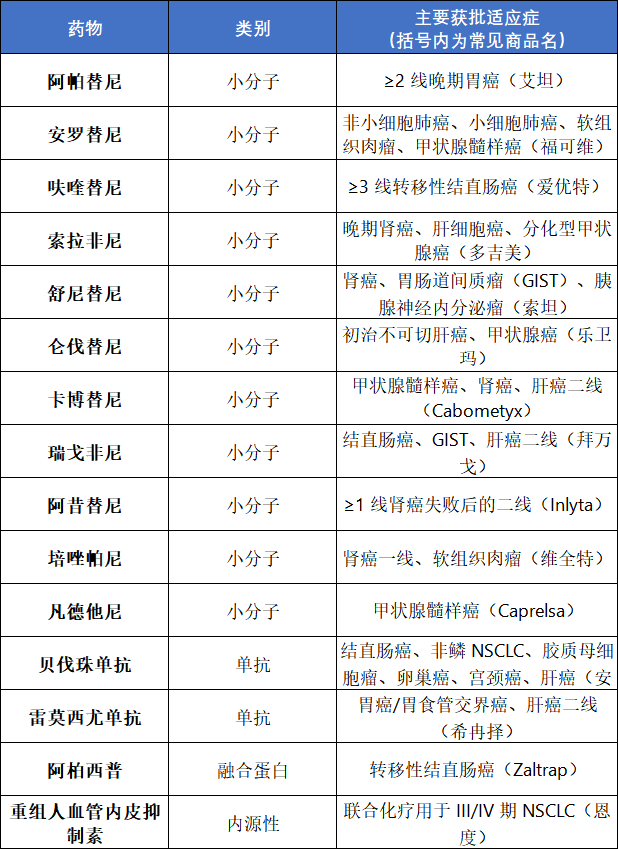
发生率较高,不同药物有所差异:
通常发生在治疗开始后的前6周,虽不危及生命但严重影响生活质量。症状从手掌或足底麻木开始,逐渐发展为红肿、疼痛,严重时出现水泡、脱皮甚至溃疡。
在人类与癌症的漫长斗争中,抗血管生成药物开辟了一条“断其粮草”的创新路径。随着科学不断发展,这类药物正从单一武器发展为多兵种协同作战的精锐部队,为更多患者带来长期生存的希望。
欢迎关注"ai帮帮",了解更多临床资讯~
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。 *版权申明:如需转载请联系小编
地址:上海市浦东新区康安路388弄1号T1栋


爱渡订阅号


爱渡服务号


邮箱:zixun@aibbang.com

爱渡小程序





