

江苏国控电力设备有限公司
Jiangsu guo kong power equipment Co., Ltd.

2024年6月13日,美国食品药品监督管理局(FDA)加速批准了瑞普替尼,用于治疗患有神经营养酪氨酸受体激酶(NTRK)基因融合、局部晚期或转移性或手术切除可能导致严重发病,以及在治疗后病情进展或没有令人满意的替代疗法的成人和 12 岁及以上的儿童实体瘤患者。
瑞普替尼于2023年11月获FDA批准第一个适应证,用于ROS1阳性局部晚期或转移性非小细胞肺癌,此次批准是该药的适应证扩展。今年5月13日,再鼎医药宣布,瑞普替尼已获中国国家药品监督管理局(NMPA)批准,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌成人患者。截至目前,瑞普替尼尚未在国内获批用于治疗NTRK阳性局部晚期或转移性实体瘤患者。
瑞普替尼是百时美施贵宝公司旗下一款靶向ROS1和NTRK的新一代酪氨酸激酶抑制剂。携带ROS1和NTRK基因融合的实体瘤患者在接受目前已获批准的靶向治疗后,通常会出现耐药突变,导致肿瘤进展。瑞普替尼是首款新一代ROS1和NTRK TKI,其能克服一代TRK抑制剂的耐药性,对TRK TKI初治/经治的患者都有效。
研究设计
此次FDA的加速批准是基于1/2期TRIDENT-1研究的结果。TRIDENT-1是一种多中心、单臂、开放标签、多队列临床试验,研究纳入了88例携带NTRK(NTRK1/2/3)基因融合阳性的局部晚期或转移性实体瘤患者,其中既往接受过TRK TKI治疗的患者有48例。
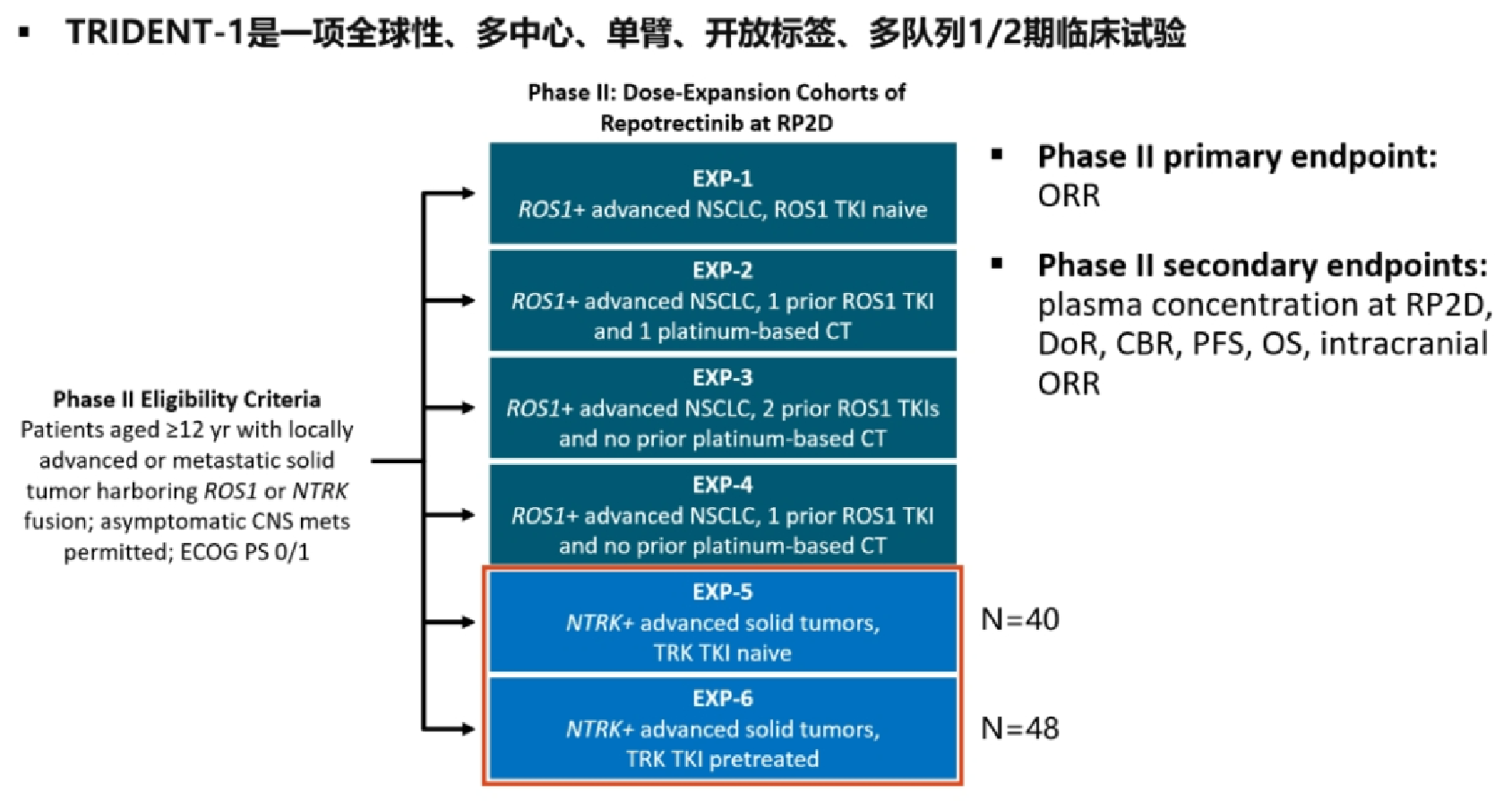
TRIDENT-1 研究设计
在TKI初治组中,48% 的患者接受过 1 线化疗(联合或不联合免疫疗法);在TKI经治组中,50% 的患者之前接受过恩曲替尼治疗,48% 的患者之前使用过拉罗替尼治疗,14% 的患者使用过另一种TKI。
TRK TKI初治患者0RR达58%,经治患者ORR为50%!
研究结果显示,无论患者是否曾接受过TRK TKI治疗,瑞普替尼都展现出了良好的疗效。在TKI初治患者中,中位随访时间为17.8个月,客观缓解率(cORR)为58%,其中43%的患者达到部分缓解(PR),15%的患者达到完全缓解(CR)。在这些达到缓解的患者中,83%的患者在接受瑞普替尼治疗一年后仍持续缓解,中位持续缓解时间(mDOR)尚未达到。在接受过TKI治疗的患者中,中位随访时间为20.1个月,cORR为50%,其中50%的患者达到PR,没有患者达到CR。此外,42%达成缓解的患者在接受瑞普替尼治疗一年后仍持续缓解,mDOR为9.9个月。
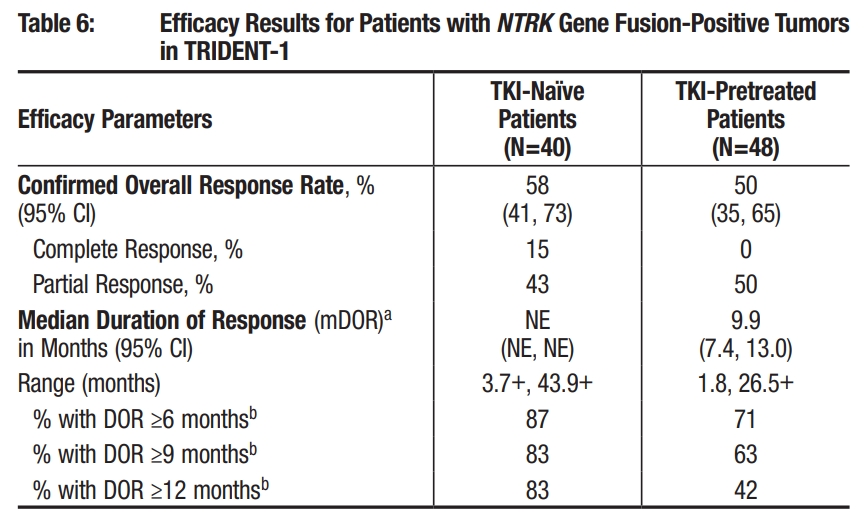
TRIDENT-1 NTRK融合阳性亚组疗效数据
在实体瘤中的疗效数据
本研究纳入的患者涵盖了15种不同类型的癌症,TKI初治的患者中,非小细胞肺癌(NSCLC)ORR为62%、甲状腺癌(Thyroid Cancer)ORR为100%、涎腺癌(Salivary Gland Cancer)ORR为100%、软组织肉瘤(Sarcoma, Soft tissue)ORR为33%、乳腺癌(Breast Cancer)2例患者疾病进展(PD)、胶质母细胞瘤(Glioblastoma)1例患者疾病稳定(SD)、胆管癌(Cholangiocarcinoma)1例患者PD、结肠直肠癌(Colorectal cancer)1例患者SD、周围神经鞘肿瘤(Peripheral Nerve Sheath Tumor)1例患者PR。
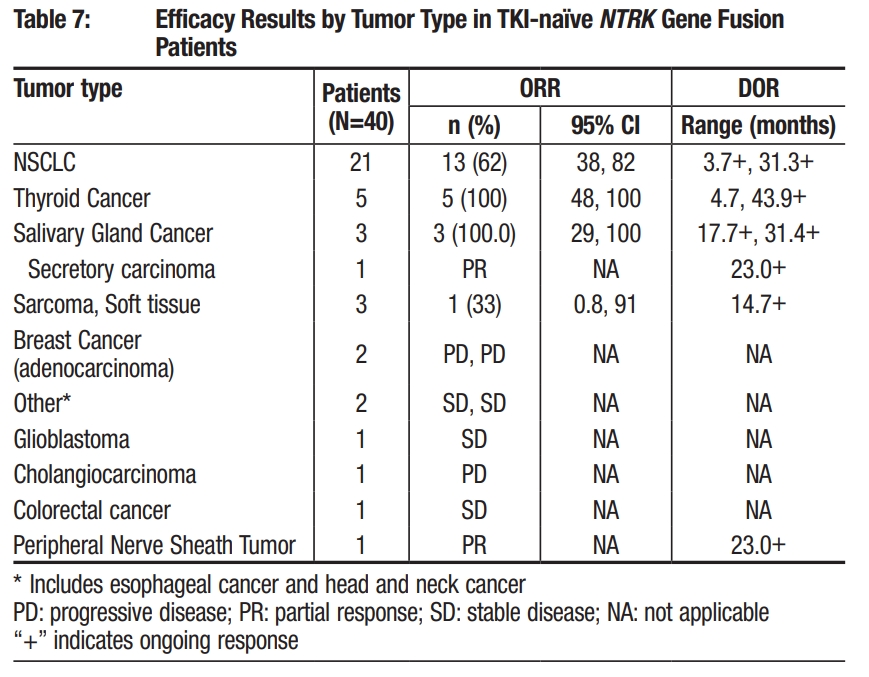
TRIDENT-1 TKI初治实体瘤疗效数据
TKI经治的患者中,非小细胞肺癌ORR为43%、涎腺癌ORR为88%、软组织肉瘤ORR为17%、甲状腺癌ORR为50%、胶质母细胞瘤ORR为33.3%、胆管癌1例患者PD,1例患者PR、结肠直肠癌1例患者PR,1例患者SD、周围神经鞘肿瘤2例患者PR、神经内分泌瘤(Neuroendocrine Tumor)2例患者PR、胰腺癌(Pancreatic Cancer)2例患者PD、乳腺癌1例患者PR。
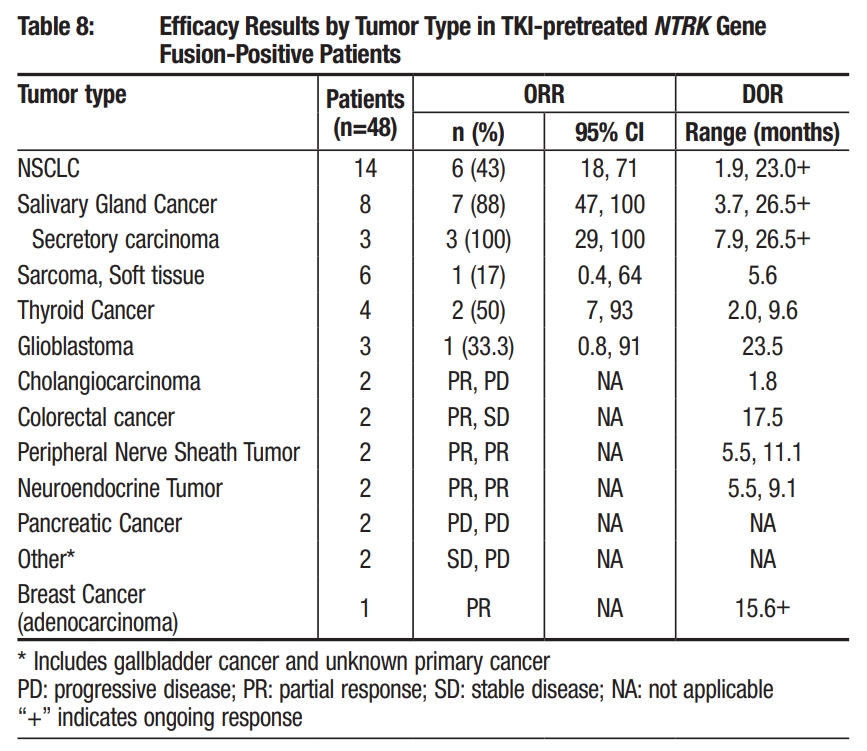
TRIDENT-1 TKI经治实体瘤疗效数据
NTRK基因融合已被确定为泛实体瘤的成人和儿童患者的致癌驱动因素,整体而言,虽然NTRK基因融合的实体瘤很罕见,但在很多肿瘤类型中均有发现。目前国内获批上市的TRK TKI包括拉罗替尼和恩曲替尼,均用于治疗NTRK融合阳性局部晚期或转移性实体瘤。希望瑞普替尼能早日在国内获批,使携带NTRK基因融合的初治和经治实体瘤患者都能获得更大的临床获益。
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编
地址:上海市浦东新区康安路388弄1号T1栋


爱渡订阅号


爱渡服务号


邮箱:zixun@aibbang.com

爱渡小程序





