

江苏国控电力设备有限公司
Jiangsu guo kong power equipment Co., Ltd.

妇瘤即妇科肿瘤,是发生在女性生殖器官的肿瘤。妇科肿瘤严重危害女性健康,长期的治疗过程及肿瘤本身会对患者造成极大痛苦,甚至带来死亡的危险。在医学不断进步的历程中,老药焕新一直是备受瞩目的领域。许多我们熟悉的经典药物,正通过全新的研究和探索,展现出了令人惊喜的潜力。2025 ASCO 大会将披露多款妇瘤药物创新疗法的最新临床数据。从免疫检查点抑制剂到叶酸受体α抗体,从单抗到双抗,让我们一起走进2025 ASCO妇瘤专题,了解妇瘤最前沿资讯!
十秒速览:
贝莫苏拜单抗已证实对子宫内膜癌有显著疗效,此次ASCO大会将首次披露由正大天晴的评估贝莫苏拜单抗联合卡铂/紫杉醇±安罗替尼,随后贝莫苏拜单抗±安罗替尼维持治疗用于晚期或复发性子宫内膜癌一线治疗的实验数据。
COMPASSION-16是一项康方生物的III期临床研究,研究结果显示,卡度尼利单抗(Cadonilimab)联合贝伐单抗用于持续、复发或转移性宫颈癌一线治疗组的中位PFS为12.7个月,安慰剂组为8.1个月,疾病进展风险显著降低。
百泰生物将披露尼妥珠单抗联合化疗用于IVB期、复发性或持续性宫颈鳞癌一线治疗的最新数据,值得期待!
百奥泰生物的叶酸受体α(FRα)抗体药物偶联物BAT8006将披露其在铂耐药卵巢癌患者中的最新数据。
1. 贝莫苏拜单抗联合卡铂/紫杉醇±安罗替尼,随后贝莫苏拜单抗±安罗替尼维持治疗用于晚期或复发性子宫内膜癌一线治疗:一项随机、开放标签、II期临床试验(摘要号:5508,陈晓军)
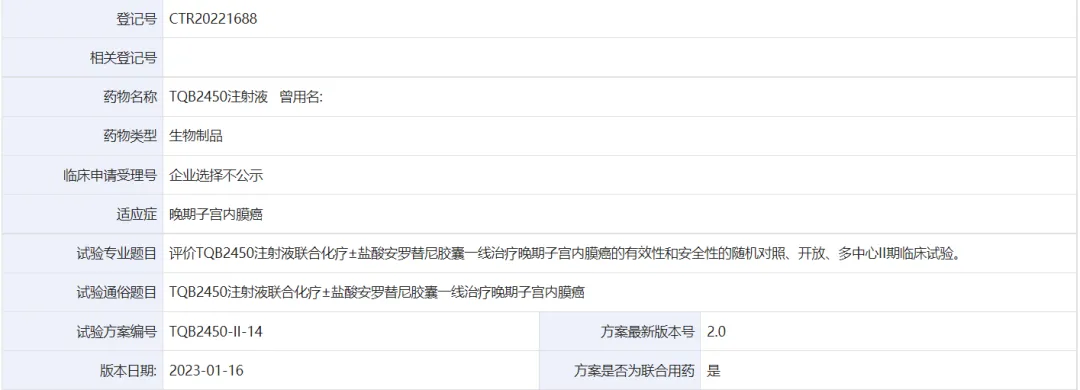
这是一项Ⅱ期临床试验,实验编号为TQB2450-II-14,由正大天晴药业集团股份有限公司和正大天晴药业集团南京顺欣制药有限公司赞助,复旦大学附属妇产科医院负责开展,主要目的为评价贝莫苏拜单抗联合化疗±盐酸安罗替尼胶囊一线治疗后贝莫苏拜单抗±盐酸安罗替尼胶囊维持治疗晚期子宫内膜癌的有效性,目前试验尚在进行中,且最新数据将在2025 ASCO大会首次披露。尽管我们对此项研究的效果还一无所知,但2024年披露的贝莫苏拜单抗(TQB2450)联合安罗替尼治疗复发或转移性子宫内膜癌(EC)患者的临床试验结果十分耀眼——独立评审委员会(IRC)确认的客观缓解率(ORR)为 34.12%,中位无进展生存期(mPFS)为 8.80 个月,中位总生存期(mOS)为 21.78 个月。因此,我们有理由相信且期待TQB2450-II-14试验将会为子宫内膜癌的治疗提供新选择。
2. 卡度尼利单抗联合含铂化疗±贝伐单抗治疗持续性、复发性或转移性宫颈癌:COMPASSION-16 亚组分析(摘要号:5509 ,吴小华)
COMPASSION-16为一项中国随机、双盲、安慰剂对照的III期临床研究,旨在研究卡度尼利单抗联合铂类为基础±贝伐珠单抗用于持续、复发或转移性宫颈癌一线治疗。该研究共445患者进入随机分配入组。联合贝伐单抗组的中位 PFS 为 12.7 个月,相较于安慰剂组的 8.1 个月,疾病进展风险显著降低;中位 OS 尚未达到。不联合贝伐单抗组的试验结果为卡度尼利单抗联合化疗可显著延长患者的中位 PFS 达 5.4 个月,疾病进展风险降低 54%;中位 OS 延长 5.4 个月,死亡风险降低 50%。研究结果提示:PD-L1阳性患者在PFS上获得了具有统计学意义的改善,PD-L1阴性PFS显示出获益趋势。不良反应总体可接受,未见新的不良反应信号。综上所述,卡度尼利单抗+标准一线方案治疗复发、转移或持续性宫颈癌是临床可考虑的新选择。期待后续更长时间的随访数据、DOR及其他生存数据、以及转移患者中不同转移部位对疗效影响的官方数据
3. 尼妥珠单抗联合化疗用于IVB期、复发性或持续性宫颈鳞癌一线治疗:一项多中心、随机、双盲、对照研究(摘要号:5510,Zexuan Liu)
尼妥珠单抗是一种人源化抗表皮生长因子受体(EGFR)单克隆抗体,可通过特异性结合 EGFR 抑制细胞增殖、影响血管生成、促进凋亡等发挥抗肿瘤作用。另一项多中心回顾性研究显示,在局部晚期宫颈癌患者中,与单纯放化疗相比,尼妥珠单抗联合放化疗可使患者的 CR 率从 26.7% 提升至 51.7%,ORR 从 87.4% 提升至 98.3%。这表明尼妥珠单抗联合化疗能在短期内更有效地控制肿瘤,使肿瘤缩小甚至消失。但该研究主要针对局部晚期宫颈癌,且随访时间和样本量有限,对于 IVB 期、复发性或持续性宫颈鳞癌患者,让我们一起期待本次大会上披露的数据!

4. 叶酸受体α(FRα)抗体药物偶联物BAT8006用于铂耐药卵巢癌患者的安全性和有效性:BAT-8006-001-CR试验剂量优化/扩展队列更新(摘要号:5517,张松灵)
这是一项由研究者发起的、多中心、开放标签的剂量递增和队列扩展研究,旨在评估 BAT8006 在晚期实体瘤患者中的安全性、耐受性、药代动力学和初步疗效。试验纳入既往接受过至少一线但不超过三线铂类化疗,且至少接受过一种贝伐珠单抗或其他血管生成抑制剂、PARP 抑制剂治疗的铂耐药卵巢癌患者,要求患者 FRα 表达阳性,即免疫组化检测 ≥25% 的肿瘤细胞表达 FRα 且强度 ≥2+。过往披露的数据显示BAT8006 的安全性可控,常见不良反应(≥20%)包括中性粒细胞减少、白细胞减少、恶心、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、呕吐、乏力、血小板减少和腹泻。严重不良反应发生率为 12.5%。在可评估疗效的 40 例患者中,ORR 达 42.5%,即有 17 例患者肿瘤显著缩小。DCR 为 67.5%,中位 PFS 达 5.4 个月,即患者在接受治疗后平均 5.4 个月内疾病未出现进展。BAT-8006-001-CR 试验剂量优化 / 扩展队列的已有结果显示,BAT8006 在铂耐药卵巢癌患者中具有良好的耐受性和显著的抗肿瘤活性,为这类患者提供了一种新的潜在治疗选择。目前该试验仍在进行中,未来还需更长时间的随访和更多患者数据来进一步验证其长期疗效和安全性。
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。 *版权申明:如需转载请联系小编
地址:上海市浦东新区康安路388弄1号T1栋


爱渡订阅号


爱渡服务号


邮箱:zixun@aibbang.com

爱渡小程序





