

江苏国控电力设备有限公司
Jiangsu guo kong power equipment Co., Ltd.

2025年6月23日,美国FDA宣布了一项重大决定:加速批准抗体偶联药物德达博妥单抗(Datopotamab deruxtecan,商品名Datroway)用于治疗既往接受过 EGFR 靶向治疗和铂类化疗的局部晚期或转移性 EGFR 突变非小细胞肺癌(NSCLC)成人患者。。
这使德达博妥单抗成为全球首个获得FDA批准的针对肺癌的TROP2靶向疗法,为那些已经用尽EGFR靶向药和铂类化疗却依然面临疾病进展的患者提供了新的生命线。
在医学界,这一批准被视为肺癌治疗领域的重要里程碑。非小细胞肺癌占所有肺癌病例的近87%,而亚洲患者中EGFR突变比例高达40%,远高于欧美的10-15%,因此,这款药物对中国患者意义重大!
1
破局时刻:后线治疗的突破性进展
对于携带EGFR突变的晚期非小细胞肺癌患者,标准治疗路径清晰却有限:一线使用EGFR靶向药物,耐药后转向铂类化疗。一旦这两道防线被疾病攻破,患者的选择变得极为有限,生存希望随之黯淡。
“解决晚期EGFR突变肺癌患者在靶向治疗和化疗后的疾病进展问题非常具有挑战性,因为可用的后线治疗方案有限。” Dana-Farber癌症研究所的Jacob Sands博士解释道。
这一困境正在被改写。2025年6月23日,第一三共和阿斯利康共同宣布,其合作开发的TROP2 ADC药物德达博妥单抗获得FDA加速批准,用于治疗既往接受过EGFR靶向疗法和铂类化疗的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。
此前的 2025 年 1 月,德达博妥单抗已获批用于治疗既往接受过内分泌治疗和化疗的 HR 阳性、HER2 阴性不可切除或转移性乳腺癌成人患者。此次获批,使德达博妥单抗成为全球首个获批用于肺癌治疗的 TROP2 靶向疗法,为晚期 EGFR 突变 NSCLC 患者带来了新的治疗选择。
2
独特机制:精准制导的“生物导弹”
德达博妥单抗代表了当今肿瘤治疗最前沿的抗体偶联药物技术(ADC)。这类药物被誉为“生物导弹”,其设计融合了三大科学突破:
精准导航系统:药物搭载的人源化单克隆抗体能够精确识别癌细胞表面过度表达的TROP2蛋白(滋养层细胞表面抗原2),这种蛋白在非小细胞肺癌中普遍高表达。
高效杀伤弹头:通过可裂解连接子,每个抗体分子携带4个强效DNA拓扑异构酶I抑制剂(DXd)载荷。
智能杀伤机制:药物被癌细胞内化后,在细胞内释放毒素,诱导DNA损伤和细胞凋亡。其独特之处在于释放的毒素能够穿透细胞膜,产生“旁观者效应”,杀死邻近的癌细胞,即使这些细胞TROP2表达不高。
这种设计使德达博妥单抗既能精准打击肿瘤细胞,又能克服肿瘤异质性带来的治疗挑战,显著区别于传统化疗的无差别攻击模式
3
临床实证:耐药患者迎来新希望
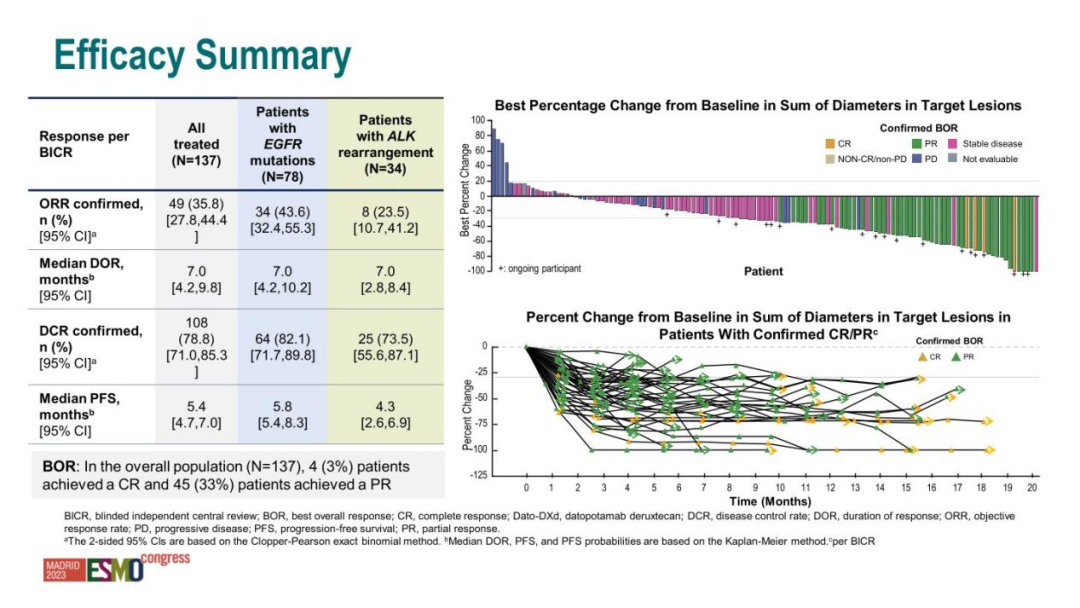
此次获批基于两项关键临床研究——TROPION-Lung05 II期试验和TROPION-Lung01 III期试验的亚组分析结果。
在114例经EGFR靶向药及化疗失败的晚期EGFR突变NSCLC患者中,独立评估显示出了令人振奋的数据:客观缓解率(ORR)达到45%(95% CI:35-54),意味着近半数传统治疗失效的患者实现了肿瘤显著缩小。
其中,4.4%的患者达到完全缓解(肿瘤完全消失),40%的患者达到部分缓解(肿瘤显著缩小)1。药效持续的中位时间为6.5个月(95% CI:4.2-8.4),部分患者的缓解持续时间长达22个月。
这些数据显著优于当前标准治疗方案。传统化疗药物多西他赛在类似患者群体中的客观缓解率仅为10%左右。
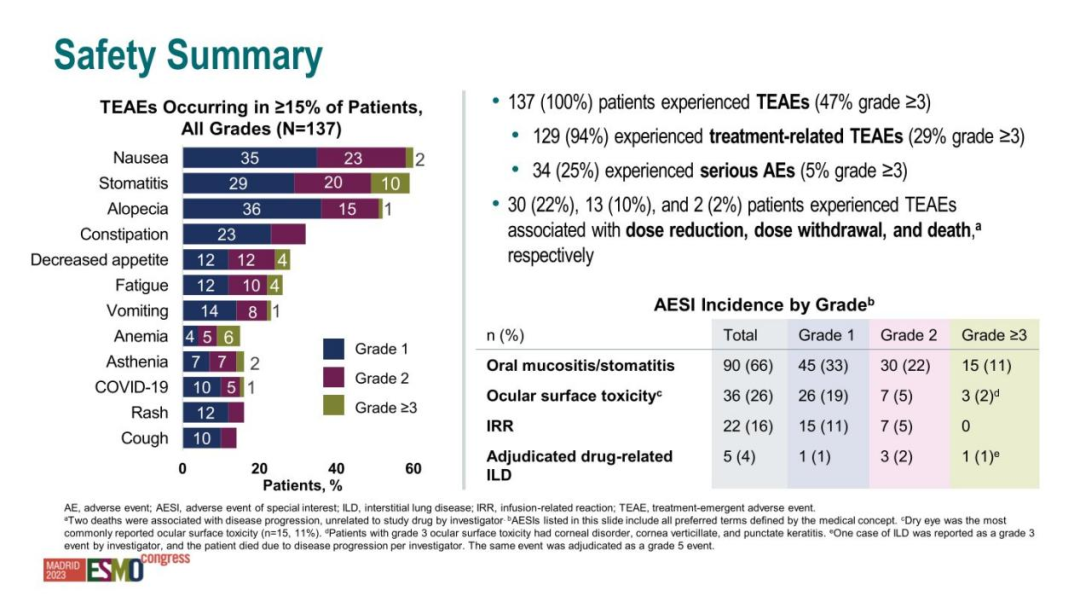
在三项试验(TROPION-Lung05、TROPION-Lung01和TROPION-PanTumor01)的125例患者汇总安全性分析中,研究人员评估了德达博妥单抗(6mg/kg)的安全性。
最常见的不良反应(≥20%)包括:口腔炎、恶心、脱发、疲劳、血红蛋白降低、淋巴细胞减少、便秘等1。26%的患者出现了严重不良反应,其中最常见的是COVID-19、口腔炎和肺炎(发生率超过1%)。
特别值得关注的是间质性肺病(ILD)/肺炎风险,这一不良反应在整体使用德达博妥单抗的患者中发生率约为7%。为此,FDA要求药物标签中包含黑框警告,提示医生和患者注意这一风险。
然而,与化疗相比,德达博妥单抗的安全性仍具优势。在乳腺癌适应症的研究中,德达博妥单抗治疗组3级或以上治疗相关不良事件发生率仅为21%,不到化疗组(45%)的一半。
4
加速批准:意义与后续责任
FDA此次采用加速批准途径,是基于客观缓解率(ORR)和缓解持续时间(DoR)这两个替代终点。在肿瘤药物审批中,这种途径允许基于早期指标提前批准满足未竟医疗需求的药物。 但加速批准附带重要条件:药企必须进行确证性试验,证明药物能带来临床生存获益。德达博妥单抗的持续批准将取决于正在进行的III期临床试验能否验证其临床价值。 在全球TROP2 ADC竞争格局中,科伦博泰的芦康沙妥珠单抗(sac-TMT)已于2025年3月在中国获批用于相同适应症,成为全球首个在肺癌适应症获批上市的TROP2 ADC药物。目前全球共有三款TROP2 ADC获批上市,但此前适应症均限于乳腺癌。吉利德旗下的戈沙妥珠单抗(Sacituzumab Govitecan)也在2024年12月获得FDA突破性疗法认定,用于治疗小细胞肺癌。
研发之路仍在延伸。第一三共和阿斯利康已启动TROPION-Lung14和TROPION-Lung15三期临床试验,探索德达博妥单抗单药或联合奥希替尼一线治疗EGFR突变肺癌的潜力。
与此同时,科伦博泰与默沙东在全球布局了10项针对非小细胞肺癌的III期临床试验,从晚期后线治疗到术后辅助早期。随着这些研究的推进,ADC药物有望重塑非小细胞肺癌的全病程治疗格局。
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。 *版权申明:如需转载请联系小编
地址:上海市浦东新区康安路388弄1号T1栋


爱渡订阅号


爱渡服务号


邮箱:zixun@aibbang.com

爱渡小程序





