

江苏国控电力设备有限公司
Jiangsu guo kong power equipment Co., Ltd.

在肿瘤免疫治疗的前沿领域,B7H3(也称 CD276)正崭露头角,成为继 PD-1/PD-L1 之后备受瞩目的新靶点。
这些新型“生物导弹”在晚期前列腺癌、小细胞肺癌等难治性肿瘤中展现出惊人的控制力,为全球抗癌战线带来突破性进展。
B7H3靶点研发竞赛已悄然成为全球肿瘤治疗领域的新焦点。明慧医药、宜联生物、翰森制药、映恩生物等中国企业凭借自主创新技术平台和前瞻性布局,不仅跻身全球第一梯队,更引领着B7H3靶向药物的开发方向。中国创新药企手握精准制导的“生物导弹”,正将晚期实体瘤的治疗推向全新纪元。
1
B7H3:肿瘤的双面间谍
B7H3(又称CD276)是B7免疫调节蛋白家族的重要成员,于2001年被首次发现。与其他免疫检查点蛋白不同,B7H3扮演着双重角色:在正常组织中保持低调表达,却在多种实体瘤中异常活跃。
1. 肿瘤免疫逃逸的帮凶
在肿瘤微环境中,B7H3堪称“完美叛徒”:
抑制免疫细胞活性:通过与T细胞表面受体结合,抑制T细胞的生长和分化,同时降低干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)等关键抗肿瘤细胞因子的分泌。
削弱自然杀伤(NK)细胞功能:表达4Ig-B7H3的肿瘤细胞能显著抵抗NK细胞的攻击,逃避天然免疫监视。
调控肿瘤相关巨噬细胞:在肝细胞癌中通过B7H3/Stat3信号通路诱导M2型巨噬细胞极化;在结直肠癌中则直接促进M2型巨噬细胞分化,形成免疫抑制环境。
2. 肿瘤代谢重编程的推手
2017年,美国南阿拉巴马大学谭明教授团队揭示了B7H3的全新角色——肿瘤代谢调控者。他们在乳腺癌研究中发现,B7H3通过双重机制促进肿瘤的“瓦伯格效应”(Warburg Effect):
激活氧感应通路:通过增加活性氧(ROS)介导的HIF-1α稳定性,上调糖酵解关键酶LDHA和PDK1的表达。
抑制抗氧化通路:阻断转录因子Nrf2入核,减少线粒体途径的能量代谢,迫使肿瘤细胞依赖糖酵解。
代谢与免疫的交叉调控使B7H3成为理想的治疗靶点。其在多种实体瘤中的高表达率令人瞩目——乳腺癌(80%)、肝癌(93.8%)、胆囊癌(66.67%),且表达水平与肿瘤侵袭、转移及不良预后显著相关
2
中国创新药企的B7H3竞速赛
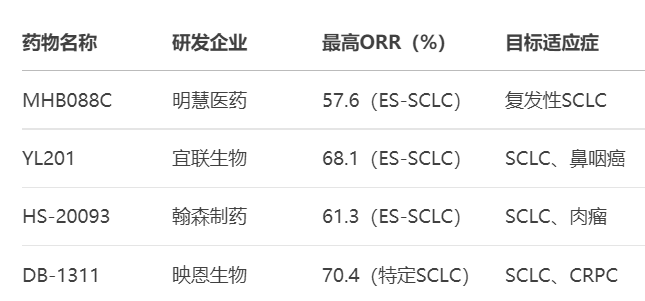
1. 明慧医药:低剂量高效的破局者
2025年ASCO年会上,同济大学附属东方医院周彩存教授报告了MHB088C治疗复发广泛期小细胞肺癌(ES-SCLC) 的I/II期研究结果。这项多中心研究显示:
在91例接受治疗的ES-SCLC患者中,三个剂量组均显示显著疗效:1.6 mg/kg Q2W组ORR 42.9%;2.0 mg/kg Q2W组ORR 57.6%;2.4 mg/kg Q3W组ORR 46.7%
中位无进展生存期(mPFS)稳定在5.5-5.9个月,为经历多线治疗失败的患者带来希望
安全性优势突出:仅报告1例(1.0%)轻度间质性肺病(ILD),主要≥3级不良反应为血液学毒性,且在1.6和2.0 mg/kg剂量组发生率仅为个位数
MHB088C的核心优势在于其分子设计:
采用SuperTopoi™有效载荷,效力比第一三共的Dxd高5-10倍
药物-抗体比(DAR)优化为4,平衡疗效与毒性
2.0 mg/kg的III期临床剂量为全球同类药物中最低
2025年5月,明慧医药与齐鲁制药达成13.45亿元人民币授权合作,后者获得MHB088C在大中华区的独家开发、生产和商业化权利。同时,MHB088C针对复发性小细胞肺癌的III期注册临床已在中国启动,计划入组450例患者,由周彩存教授担任主要研究者。
2. 宜联生物:脑转移控制的领跑者
YL201作为首个获得FDA突破性疗法认定的B7H3 ADC药物,在治疗小细胞肺癌方面展现出惊人实力:
总体人群高效:72例经治ES-SCLC患者中,客观缓解率(ORR)达68.1%,中位无进展生存期(mPFS)6.2个月1
脑转移控制卓越:在29例基线脑转移肺癌患者中,颅内疾病控制率(ic-DCR)达93.1%,中位颅内无进展生存期(ic-PFS)达6.3个月1
特殊人群表现亮眼:对未接受脑部放疗的患者,颅内客观缓解率(ic-ORR)高达57.1%
基于这些数据,YL201已在中美同步推进针对小细胞肺癌和鼻咽癌的III期临床试验(NCT06612151和NCT06629597),成为全球B7H3 ADC赛道的有力竞争者。
3. 翰森制药:多癌种拓展的先锋
HS-20093是翰森制药自主研发的B7H3 ADC,已获得中美双突破性疗法认定。其独特优势在于:
广谱抗肿瘤活性:在ARTEMIS-001研究中,对肺癌、肉瘤、头颈癌等多种实体瘤有效
骨与软组织肉瘤突破:2025 ASCO公布的II期研究显示,在既往充分治疗的复发或难治性患者中,疗效显著优于现有标准治疗
小细胞肺癌高效:在ARTEMIS-001研究的ES-SCLC队列中,8.0mg/kg剂量组ORR达61.3%,DCR 80.6%,mPFS 5.9个月
翰森制药已与GSK达成17亿美元出海协议,授权HS-20093大中华区以外的全球权益。该药针对复发性SCLC和局限期SCLC的两项III期临床研究正在进行中。
4. 映恩生物:联合治疗的探路者
映恩生物与BioNTech合作开发的DB-1311(BNT324)在2024年ESMO Asia大会上公布了令人振奋的I/IIa期数据:
SCLC人群优势显著:73例SCLC患者中,未确认ORR(uORR)达56.2%,DCR 89.0%
精准剂量发现:在9 mg/kg剂量水平下,未接受过拓扑异构酶I抑制剂治疗的SCLC患者中,uORR高达70.4%
前列腺癌潜力显现:32例去势抵抗性前列腺癌(CRPC)患者中,uORR 28.0%,DCR 92.0%,6个月rPFS率达94.7%
映恩生物计划2025年启动DB-1311与PD-L1/VEGF双抗BNT327的联合治疗试验,探索“ADC+双抗”在SCLC和NSCLC中的协同效应
3 挑战与未来:从赛道竞逐到临床实践 1. 安全性挑战 B7H3靶向治疗曾遭遇重大挫折,2019年,MacroGenics的CD3/B7H3双抗MGD009因肝脏毒性被FDA叫停临床试验;2022年,天境生物/ MacroGenics的B7H3单抗enoblituzumab因患者死亡暂停头颈癌II期研究。但新一代ADC通过技术优化显著提升了安全性: 间质性肺病(ILD)发生率普遍低于2% 主要≥3级不良反应为中性粒细胞减少(24.2%)和贫血(15.2%),临床管理相对成熟 2. 耐药机制与联合策略 克服耐药成为未来重点: 免疫联合:映恩生物计划探索DB-1311与PD-L1/VEGF双抗的联合方案 双靶点协同:百奥赛图开发B7H3/PTK7双特异性ADC;信达生物EGFR/B7H3双抗ADC IBI3001已进入临床 3. 生物标志物探索 B7H3表达与疗效相关性仍是未解之谜: 第一三共的I-DXd研究中,未发现疗效与B7H3表达水平的明显相关性 翰森制药HS-20093数据显示,B7-H3高表达患者有延长PFS的趋势 寻找更精准的患者分层标志物是未来研究方向
B7H3 在多种肿瘤中高表达且与不良预后相关,靶向B7H3的药物在临床试验中已展现良好疗效和安全性。随着研发深入,B7H3靶向治疗有望成为肿瘤免疫治疗的重要手段,为患者提供新的治疗选择。随着III期临床数据的陆续推出,谁将率先撞线上市?答案或将决定下一个肿瘤治疗时代的领跑者。
欢迎关注"ai帮帮",了解更多临床资讯~
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。 *版权申明:如需转载请联系小编
地址:上海市浦东新区康安路388弄1号T1栋


爱渡订阅号


爱渡服务号


邮箱:zixun@aibbang.com

爱渡小程序





